醫藥網4月8日訊4月3日,中國政府網發布《國務院辦公廳關于改革完善仿制藥供應保障及使用政策的意見》(下文稱《意見》)。消息一發,今早在資本市場也引起了關注,不少在積極推進仿制藥一致性評價的企業如華海藥業、京新藥業均有一定的漲幅。
在《意見》中可以看到明確的激勵政策。例如,對于通過一致性評價的產品,要及時納入采購目錄,藥品集中采購機構要按藥品通用名編制采購目錄,促進與原研藥質量和療效一致的仿制藥和原研藥平等競爭,還要促進仿制藥替代使用。
同時,相關部門要發揮基本醫療保險的激勵作用。加快制定醫保藥品支付標準,與原研藥質量和療效一致的仿制藥、原研藥按相同標準支付。通過醫保支付激勵約束機制,鼓勵醫療機構使用仿制藥。
筆者認為,加速仿制藥替代原研,是降低藥費支出的一條理想路徑。對此,本文詳細梳理了相關數據與一致性評價的相關進展。
美國
仿制藥控費的國際經驗
美國藥品研發能力很強,但同時也是全球***大的仿制藥市場,據IMS統計,2013年全球1600億美元仿制藥市場,美國就占了500億美元。過去10年,仿制藥為美國醫療衛生體系共計節省了1.67萬億美元。
圖1 美國仿制藥節省醫療衛生費用金額
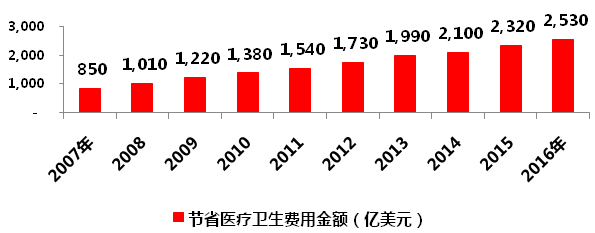
數據來源:IMS
研究顯示,仿制藥的價格將隨著參與仿制藥生產企業數量的增多而相應下降,當處于2~5家競爭時,價格迅速下滑到33%~52%,競爭廠家多了,則價格將降得更低。
圖2 仿制藥廠商數量與相對原研藥價格關系
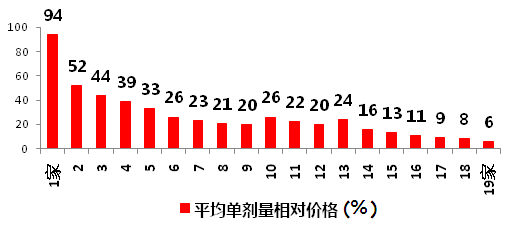
數據來源:《新英格蘭醫學雜志》
為何我國的仿制藥沒能替代原研藥及過期專利藥從而降低藥費支出呢?筆者分析,主要有以下兩個原因:
質量差異
長期以來,我國的仿制藥質量與原研藥有著巨大差距,也就不可能像國外仿制藥那樣替代原研藥,從而降低藥費支出。以扶他林(雙氯芬酸鈉)為例,國產仿制藥的生物利用度與原研藥存在較大差異。
圖3以扶他林(雙氯芬酸鈉)為例,看我國仿制藥與原研藥差距
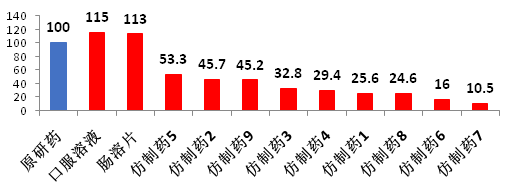
數據來源:上海醫工院
招標層次
招標時,國產藥與原研藥及過期專利藥不能在同一質量層次,原研及過期專利藥價格也就難以降低。
表1 國產仿制藥與原研藥中標價格比較
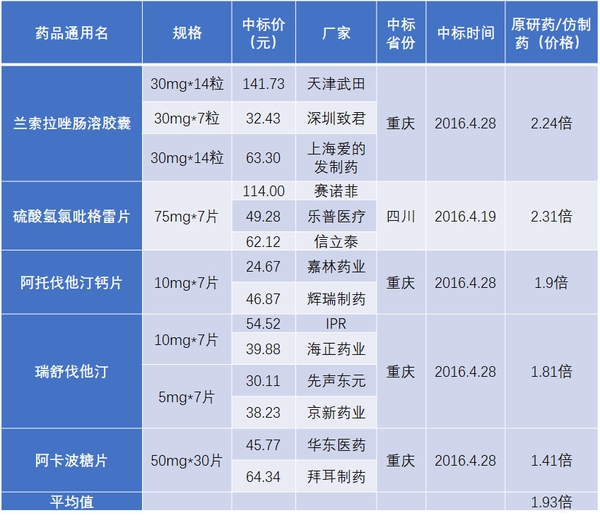
資料來源:藥智網、海通證券研究所
中國
仿制藥替代時代開啟
筆者認為,發展仿制藥的途徑基本有兩個,首先對存量批文進行一致性評價,同時加速仿制藥的研發。
一致性評價進展匯總
已通過一致性評價的品種
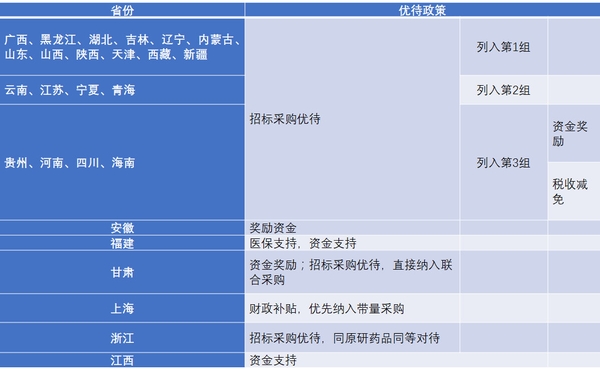
截至目前,已通過一致性評價的共15個品種(22個品規),其中289目錄外的品種達10個(17個品規),可見企業看到了一致性評價的市場潛力,主動加速了一致性評價的進程。國務院和CFDA在多個重磅文件中都提出對通過一致性評價的品種給予醫保支付、招標采購、資金支持三個斱面的優待,目前絕大多數省市也已出臺落地一致性評價優惠政策。
表2 各省市落地一致性評價品種優惠政策匯總
注射劑一致性評價
2017年12月22日,CDE發布了《已上市化學仿制藥(注射劑)一致性評價技術要求(征求意見稿)》,2018年3月13日CDE又發布了《藥物注射劑研發技術指導意見》,將注射劑一致性評價提上了議事日程。和口服固體制劑相比,注射劑覆蓋范圍更廣,涉及企業也更多。2016年我國注射劑用藥規模達7577億元,臨床使用的西藥中注射劑超過了70%。
事實上,已有多家企業提前在做注射劑一致性評價相關準備工作。截至2017年11月20日,擬進行一致性評價的注射劑品種有66個(表3),提出注射劑參比制劑備案的企業已有52家(表4)。
表3 已經提交備案資料的注射劑品種 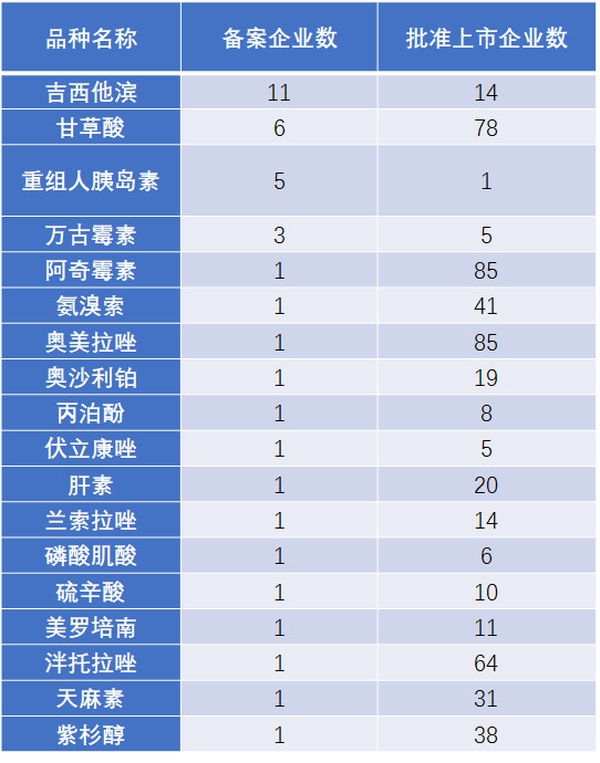
數據來源:搜狐
表4 已經提交備案資料的注射劑企業
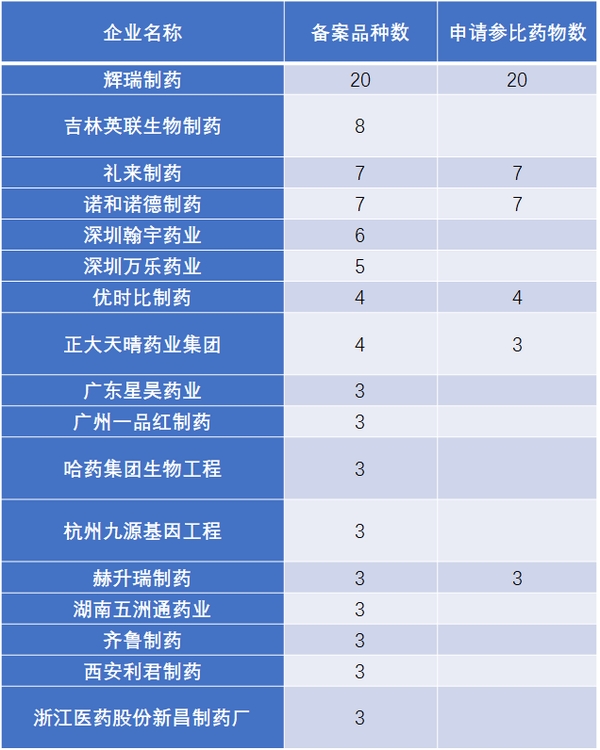
數據來源:搜狐
仿制藥替代市場空間巨大
今后一段時間,將有多個藥品專利到期,有巨大的市場空間供仿制藥替代。
圖4 到期專利藥及仿制藥替代市場潛力
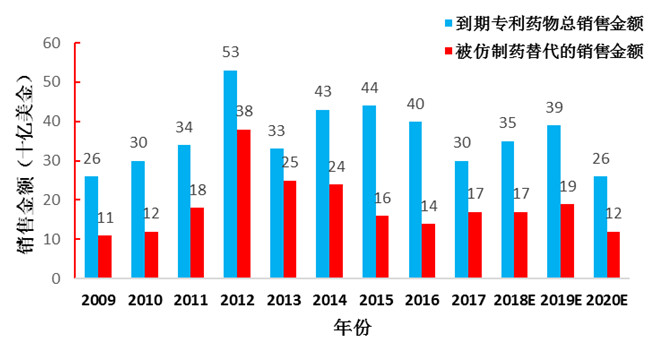
資料來源:FDA、Bloomberg、東興證券研究所
對尚未上市的在研仿制藥而言,完善專利制度是關鍵,2017年10月8日中辦國辦發布的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(42號文),提出了完善專利制度的具體措施,具體包括建立上市藥品目錄集、探索建立藥品專利鏈接制度、開展藥品專利期限補償制度試點、完善和落實藥品試驗數據保護制度等。
通過列出專利和獨占信息,保護專利權人合法權益,降低專利侵權風險,從而促進仿制藥研發的積極性。
2017年12月29日,首版《中國上市藥品目錄集》發布,共收錄了131個品種,203個品種規格,其中包括通過仿制藥質量和療效一致性評價的13個品種(17個品規)。CFDA將對新批準上市的新注冊分類藥品以及通過仿制藥質量和療效一致性評價的藥品直接納入《中國上市藥品目錄集》,實時更新。
在美國,***個向FDA遞交ANDA、并含有PIV聲明的仿制藥,如果專利挑戰成功,FDA將給予其180天的市場獨占期。這期間,FDA不再批準其他的ANDA持有人上市,該仿制藥可迅速搶占市場,并獲取高額利潤。
表5 首仿藥180天獨占期的市場價值
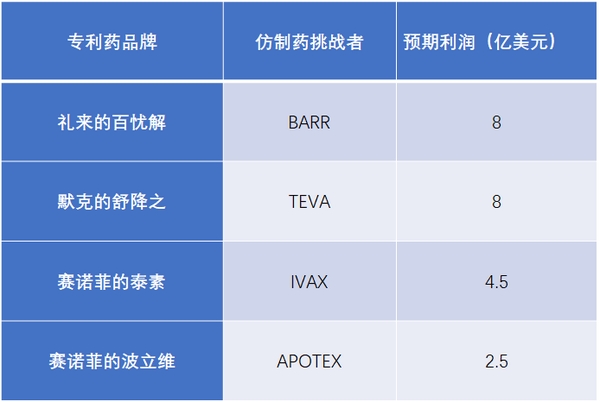
資料來源:公司公告、中信證券研究部
建立專利強制許可與藥品優先審評審批制度也有益于仿制藥研發。
圖5 優先審評審批情況
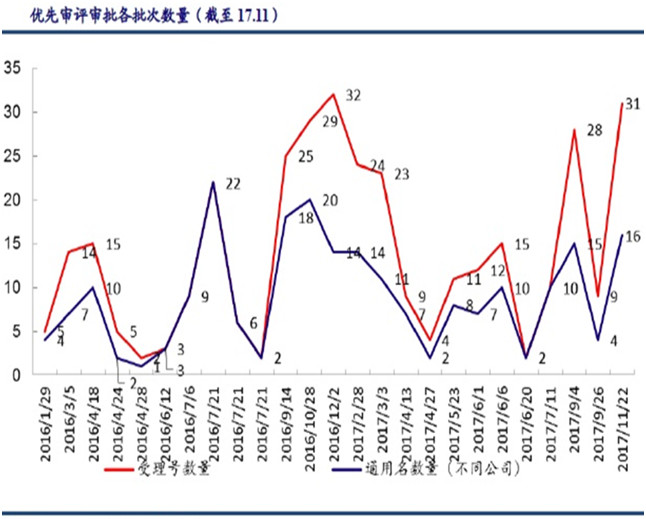
來源:CDE、中國銀行證券研究部
2017年10月20日,CDE發布了關于征求《首批專利權到期、終止、無效尚且無仿制申請的藥品清單》意見的通知,以引導仿制藥研發生產。
表6 國內藥企近幾年重要專利挑戰事件
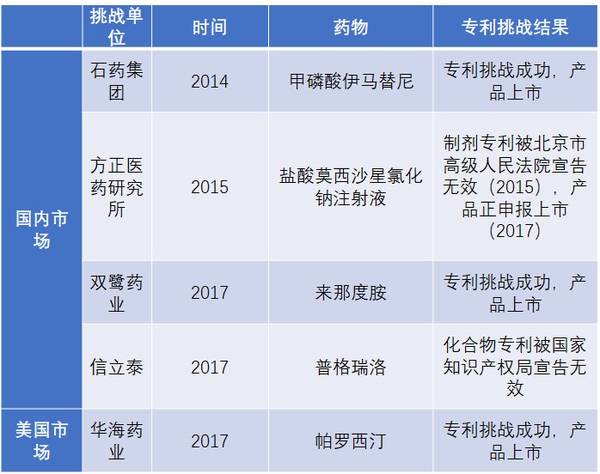
資料來源:公司公告、中信證券研究部
隨著國內藥企科研水平的不斷提高,中國制藥企業的仿制藥也得到了FDA的認可,中國藥企取得ANDA的數量由2008年的4個上升到了2017年的38個(圖6),其中僅華海藥業美國分公司普林斯頓2017年就在FDA獲批了10個ANDA(圖7)。在國內,CFDA還對“在中國境內用同一批生產線生產并在美國、歐盟藥品審批機構同步申請上市且通過了其現場檢查的藥品注冊申請”給予優先審評審批資格等優待措施。
圖6 近10年來FDA批準的中國藥企ANDA(按申請號計)
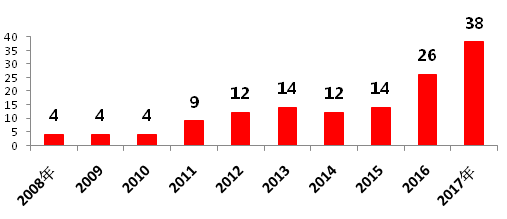
資料來源:藥智網
圖7 2017年中國藥企獲FDA批準ANDA數排名(按申請號計)
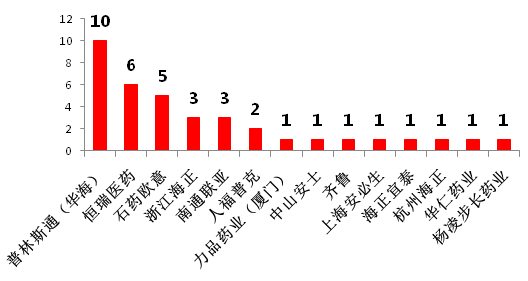
資料來源:藥智網
加快一致性評價進程,對通過一致性評價的產品在招標采購和醫保支付等方面給予和原研藥同等待遇,不斷完善專利制度,完善仿制藥研發環境,加速仿制藥發展,多舉并進,提高原研替代率,切實減輕患者負擔。